烧杯中装了100克浓度为10%的盐水,向该烧杯中加入一定量未知浓度的盐水后,烧杯中的盐水浓度变为15%,继续向烧杯中加入等量的该未知浓度的盐水后,烧杯中的盐水浓度变为17.5%。那么加入烧杯中的盐水的浓度是()(假设烧杯中盐水不会溢出)A、20%B、25%C、30%D、32%
题目
烧杯中装了100克浓度为10%的盐水,向该烧杯中加入一定量未知浓度的盐水后,烧杯中的盐水浓度变为15%,继续向烧杯中加入等量的该未知浓度的盐水后,烧杯中的盐水浓度变为17.5%。那么加入烧杯中的盐水的浓度是()(假设烧杯中盐水不会溢出)
- A、20%
- B、25%
- C、30%
- D、32%
相似考题
更多“烧杯中装了100克浓度为10%的盐水,向该烧杯中加入一定量未知浓”相关问题
-
第1题:
甲、乙两个烧杯装有一些盐水,甲杯中盐水的质量是乙杯的2倍,但甲杯盐水的浓度是乙杯的1/2,则将两个烧杯中的盐水混合后得到的盐水浓度为甲杯浓度的多少倍?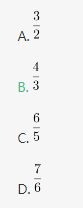 答案:B解析:第一步,本题考查溶液问题,属于溶液混合类,用赋值法解题。
答案:B解析:第一步,本题考查溶液问题,属于溶液混合类,用赋值法解题。
第二步,具体赋值如下表: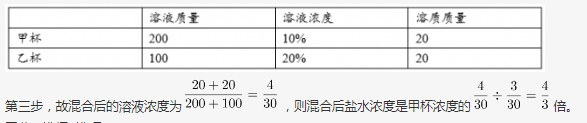
-
第2题:
实验室有四个烧杯,每个烧杯下放置一张小纸条:第一个写着“所有的烧杯中都有硫酸”;第二个写着“本杯是氯化钠”;第三个写着“本杯不是水”,第四个写着“有些烧杯中没有硫酸”。如果这四个烧杯对应的话只有一句是真的,那么以下哪项必定为真?A.第一个烧杯中是硫酸
B.第二个烧杯中是氯化钠
C.第三个烧杯中是水
D.第四个烧杯中不是硫酸答案:C解析:第一步,本题考察真假推理。第二步,先找关系,第一个烧杯和第四个烧杯上写的话是矛盾关系。再看其余,第二个烧杯和第三个烧杯上写的话为假。因此,选择C选项。 -
第3题:
案例:
下面是某教师“分子与原予”的教学片段实录。
【演示实验1】品红在水中扩散,并提问学生,你看见了什么?怎样解释这种现象?
【得出结论1】宏观物质都是由微小的粒子——分子、原子构成的。分子、原子是真实存在的。
【演示实验2】A烧杯是水,水中滴加酚酞试剂,得到无色溶液;B烧杯中是浓氨水。用一只大烧杯把A、B两烧杯罩在一起。几分钟后,观察到小烧杯A中的溶液变成了红色。上述现象说了什么?并用简单的实验证明自己的解释。
【学生猜想】①A烧杯内滴入的酚酞要过一会儿才能变红,与B烧杯无关。②大烧杯壁上沾有某种物质,散发出的肉眼看不见的微粒与烧杯A中的溶液接触,使其变红。③烧杯B中的浓氨水散发出一种肉眼看不见的微粒,慢慢溶解到烧杯A的溶液中.使A溶液变成红色。
【设计方案,进行探究】
①用洁净烧杯c装水,滴加酚酞试剂。静置,观察现象,将其单独罩在大烧杯里,观察现象。
②另取两只烧杯,重新配好A烧杯中的溶液,B烧杯内用蒸馏水代替浓氨水,用大烧杯罩住A、B烧杯,观察现象。
③小心闻8烧杯的浓氨水,嗅到刺激性气味。取少量浓氨水于试管中,滴入酚酞试剂,观察现象。
【得出结论2】__________.
【分组实验】
A组:一杯开水,一杯冷水,同时放入质量相当的品红,观察现象。
B组:下面一个集气瓶盛红棕色的二氧化氮气体.上面一个集气瓶盛空气.抽走中间玻璃片,观察现象。
C组:①50 ml水与50 ml水混合;②50 ml酒精与50 ml酒精;③50 ml水与50 ml酒精混合。
D组:各取两支大小相同的医用注射器,将栓塞向外拉,分别吸入等体积的空气和水,用手指顶住针筒末端的小孔.将栓塞慢慢推入。
【得出结论3】___________。
问题:
(1)在上述教学过程中,该教师采用了什么教学方法?与接受式教学相比,具有什么优缺点?
(2)为了验证学生的猜想.由设计的实验方案,可以得出结论2是什么?从学生分组实验中
可以得出结论3是什么?
3)请你分析本教学设计符合新课程改革的哪种教学理念,优点是什么。答案:解析:【知识点】化学实验、化学教学实施能力——分子与原子
(1)采用了探究教学方法。
探究式教学相比接受式教学.更注重过程的体验。该课程主要采用实验探究教学,所花费的时间比接受式教学长得多,需要给学生以充分的时间体验探究过程。如果为了赶进度而在学生没有进行足够思考的情况下,草率得出结论,这样的知识对学生而言是支离破碎的,很难应用。
(2)得出结论2:①氨水能使酚酞试剂变红;②8烧杯浓氨水中有肉眼看不见的微粒逸出,有些微粒进入A烧杯中的溶液。使溶液成分改变,颜色变红。
得出结论3:分子总是不断地运动的,温度越高,运动速率越快。分子之间有间隔,气态物质的徽粒间隔比较大.固态、液态物质的微粒间隔比较小。
(3)该教学过程设计符合新课标中的让学生进行自主学习,较好地体现了以学生发展为本的教学理念。
自主学习的优点:能培养学生主动发展的能力,能使学生形成良好的学习品质,能培养学生充分的自信心,能培养学生的创造力,能激发学生的好奇心。 -
第4题:
从装有120克浓度为80%的盐水的烧杯中倒出60克盐水后,再加入60克清水并使之混合均匀。接着重复以上步骤2次,问最终烧杯中的盐水的浓度为多少?()
A.10%
B.12.5%
C.15%
D.17.5%答案:A解析:
-
第5题:
在烧杯中溶样时,应加盖表面皿,加入溶剂时应从()缓缓加入,轻摇烧杯,如反应激烈,应()加入溶剂。
正确答案:沿烧杯内壁;少量多次 -
第6题:
烧杯中盛有含石蕊的氢氧化钠溶液,逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是()。
- A、紫色—红色—蓝色
- B、蓝色—紫色—红色
- C、蓝色—红色—紫色
- D、紫色—蓝色—红色
正确答案:B -
第7题:
在测量盐水密度的实验步骤中,下列步骤中不必要的是()
- A、用天平测出烧杯的质量m1
- B、往烧杯内倒入适量的盐水,用天平测出烧杯和盐水的总质量m1
- C、用量筒测出烧杯中液体的体积V
- D、用天平测出倒掉盐水后空烧杯的质量m2
正确答案:A -
第8题:
在烧杯中溶样时,应加盖()皿,加入溶剂时应从()缓缓注入,轻摇烧杯,如反应激烈,应少量多次加入试剂
正确答案:表面;烧杯嘴 -
第9题:
填空题创新组烧杯中的盐水沸腾时,其沸点为____℃.正确答案: 103解析:
液体在沸腾过程中,不断从外界吸热.却保持温度不变,所以保持不变的温度即为液体的沸点,由表中记录的数据可知,盐水的沸点是103℃. -
第10题:
单选题称取天然状态物钢渣500g,放在烧杯中,加入约()纯净水,至烧杯的标线处,盖上玻璃盖。A1200ml
B1500ml
C1300ml
D1100ml
正确答案: C解析: 暂无解析 -
第11题:
单选题在测量盐水密度的实验步骤中,下列步骤中不必要的是()A用天平测出烧杯的质量m1
B往烧杯内倒入适量的盐水,用天平测出烧杯和盐水的总质量m1
C用量筒测出烧杯中液体的体积V
D用天平测出倒掉盐水后空烧杯的质量m2
正确答案: B解析: 暂无解析 -
第12题:
单选题制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu2FeCl3+CuCl3。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是()。A烧杯中有铜无铁
B烧杯中有铁无铜
C烧杯中铁、铜都有
D烧杯中铁、铜都无
正确答案: C解析: 铁的还原性大于铜,所以B项结果不可能出现。 -
第13题:
实验室A、B两烧杯中分别装了300克浓度为13%和700克浓度为7%的盐酸溶液,为了对同学们进行盐酸的相关教学,某老师用两只试管分别从A、B烧杯中取出等量的溶液,但由于没有标注,教学完成之后他把取自A烧杯的盐酸溶液倒入了B,把取自B烧杯的盐酸溶液倒入了A。之后,测得A、B两烧杯中盐酸浓度相同。那么从两烧杯中取出的盐酸为( )克。A. 126
B. 210
C. 378
D. 525答案:B解析:A、B盐酸含盐量分别为300×13%=39和700×7%=49,所以盐酸的总量为39+49=88。由于最后A、B浓度相同,所以A、B的溶液的浓度都为8.8%, 然后用十字交叉法求得A溶液中13%和7%的溶液的比为3:7。从而得出答案。 -
第14题:
甲烧杯内装有300克浓度为60%的酒精溶液,乙烧杯中有200克水,将甲烧杯中溶液的1/3倒入乙烧杯,混合后再将其中的一部分倒回甲烧杯,此时甲烧杯中酒精溶液的浓度为45%。问这时甲烧杯内的溶液有多少克?A.260
B.280
C.300
D.320答案:D解析:第一步,本题考查溶液问题,属于溶液混合。
第二步,根据题意把甲烧杯中溶液的1/3倒入乙烧杯,这时乙烧杯中酒精浓度为100×60%÷300=20%,甲烧杯还剩200克浓度为60%的酒精溶液,设将x克溶液倒回甲烧杯,可得等式20%×x+200×60%=45%(x+200),解得x=120(克),这时甲烧杯内的溶液有120+200=320(克)。
因此,选择D选项。 -
第15题:
某烧杯装有一定体积的纯酒精,倒出50mL之后,加入纯水补充溶液至原体积,再倒出30mL,再加入纯水补充溶液至原体积,此时溶液的浓度为75%,则烧杯开始装有的纯酒精有( )mLA.300
B.350
C.380
D.435
E.500答案:A解析:
-
第16题:
烧杯中装了100克浓度为10%的盐水,向该烧杯中加入一定量未知浓度的盐水后,烧杯中的盐水浓度变为15%,继续向烧杯中加入等量的该未知浓度的盐水后,烧杯中的盐水浓度变为17.5%。那么加入烧杯中的盐水的浓度是多少?(假设烧杯中盐水不会溢出)( )A. 20%
B. 25%
C. 30%
D. 32%答案:B解析:
-
第17题:
480克18%的稀硫酸配制错误的是()。
- A、将90克96%的浓H2SO4慢慢加到盛有390克蒸馏水的烧杯中,混合均匀
- B、将88克96%的浓H2SO4慢慢加到盛有390克蒸馏水的烧杯中,混合均匀
- C、将144克60%的浓H2SO4慢慢加到盛有336克蒸馏水的烧杯中,混合均匀
- D、将96克90%的浓H2SO4慢慢加到盛有384克蒸馏水的烧杯中,混合均匀
正确答案:B -
第18题:
过滤过程中漏斗位置的高低以漏斗颈的出口多少为度()。
- A、低于烧杯边缘5mm
- B、触及烧杯底部
- C、不接触滤液
- D、位于烧杯中心
- E、高出滤液5cm
正确答案:C -
第19题:
现在有一份清漆,成装在烧杯中,烧杯重105克,将该成装清漆的烧杯放在天平上称重显示为195克,在将该清漆放在炉中145℃烘烤25分钟,拿出后放凉称重为145克,计算该清漆的固体份为多少?
正确答案:清漆重:195-105=80克
烘干后清漆重:145-105=40克
固体份:40÷80×100%=50% -
第20题:
取两根金属铜棒,将一根插入盛有0.1mol·dm-3CuSO4溶液的烧杯中,另一根插入盛有1mol·dm-3CuSO4溶液的烧杯中,并用盐桥将两支烧杯中的溶液连接起来,可以组成一个浓差原电池。
正确答案:正确 -
第21题:
填空题用天平测出空烧杯的质量为17g,在烧杯中倒入适量的酱油,测出烧杯和酱油的总质量如图甲所示,将烧杯中的酱油全部倒入量筒中,酱油的体积如图乙所示,则烧杯中酱油的质量为____g,酱油的密度为____kg/m3.正确答案: 45,1.125×103解析:
在天平的标尺上,一个小格代表的质量是0.2g,即天平的分度值为0.2g,烧杯和酱油的总质量是m1=50g+10g+2g=62g,空烧杯的质量为m2=17g,烧杯中酱油的质量为m=m1-m2=62g-17g=45g;量筒的分度值为1cm3,量筒中酱油的体积为V=40cm3;酱油的密度为ρ=m/V=45g/40cm3=1.125g/cm3=1.125×103kg/m3. -
第22题:
单选题烧杯中装了100克浓度为10%的盐水。每次向该烧杯中加入不超过14克浓度为50%的盐水。问最少加多少次之后,烧杯中的盐水浓度能达到25%( )(假设烧杯中盐水不会溢出)A6
B5
C4
D3
正确答案: B解析: -
第23题:
单选题甲、乙两烧杯分别装有浓度为50%、10%的盐水200克,先将甲烧杯盐水的一半倒入乙烧杯,充分混合后,再将乙烧杯盐水的一半倒入甲烧杯,混合均匀后,再次将甲烧杯的部分盐水倒人乙烧杯,使得两烧杯的盐水量重新恢复到200克。则此时,甲烧杯盐水的浓度为:A26%
B30%
C34%
D40%
正确答案: C解析:
