向51g氢氧化钠溶液中,加入40%(密度1.3)的H2SO4溶液24ml,所得溶液的PH值等于7,求氢氧化钠的质量分数(%)是多少?(相对原子质量:S=32,Na=23,O=16,H=1)
题目
向51g氢氧化钠溶液中,加入40%(密度1.3)的H2SO4溶液24ml,所得溶液的PH值等于7,求氢氧化钠的质量分数(%)是多少?(相对原子质量:S=32,Na=23,O=16,H=1)
相似考题
更多“向51g氢氧化钠溶液中,加入40%(密度1.3)的H<sub>2”相关问题
-
第1题:
现有A、B、C三种盐,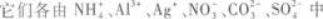 的两种离子组成.它们都易溶于水,用其水溶液做如下实验,实验现象是:
的两种离子组成.它们都易溶于水,用其水溶液做如下实验,实验现象是:
(1)向3种溶液中分别加入盐酸并加热,A溶液与盐酸不反应;B溶液有白色沉淀生成;C
溶液则生成无色无味气体.
(2)向A溶液中加入氢氧化钠溶液,先生成白色沉淀,再继续加氢氧化钠溶液时,沉淀消失.
(3)向C溶液中加入过量氢氧化钠溶液并加热,产生一种有刺激性气味的气体.根据以上现象,可判断A为____________,C为____________答案:解析: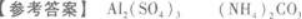 【解题指要】
【解题指要】
(1)向三种溶液中分别加入盐酸并加热.
①B溶液产生白色沉淀,说明B溶液中含有Ag+.易溶于水的银盐只有AgNO3,所以B物质
是AgNO3.

(2)向A溶液中加入NaOH溶液.

所以,A物质是Al2(SO4)3,B物质是AgNO3,C物质是(NH4)2CO3. -
第2题:
在COD测定中,我国规定的标准方法是();在此方法中,需要在水样中加入Ag2SO4-H2SO4溶液30ml,加入Ag2SO4-H2SO4溶液的作用是();同时,在加热回流两个小时里,必须保持溶液的()色。
正确答案:重铬酸钾法;促使水中直链烃类的分解;黄 -
第3题:
在磷酸钠溶液中加入足量硝酸,再加入(NH4)2MoO4溶液得到的黄色沉淀是()
- A、Na2MoO4·6H2O
- B、MoO3
- C、MoPO4
- D、(NH4)3[P(Mo12O40)]·6H2O
正确答案:D -
第4题:
在Hg2(NO3)2的溶液中,加入哪种试剂时,不会发生歧化反应()。
- A、浓HCl
- B、H2S
- C、NaCl溶液
- D、NH3·H2O
正确答案:C -
第5题:
下列化学方程式或离子方程式正确的是()。
- A、常温下,将铁片置于浓硝酸中:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O
- B、向氯化铵的稀溶液中加入少量NaOH:NH4++OH-=NH3↑+H2O
- C、向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓
- D、向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
正确答案:D -
第6题:
在配位滴定中,为了消除H+的影响,维持溶液pH在允许的范围内,要加入一定量的()。
- A、缓冲溶液
- B、蒸馏水
- C、盐酸
- D、氢氧化钠溶液
正确答案:A -
第7题:
混合溶液A为紫红色。向A中加入浓盐酸并微热得兰色溶液B和气体C。A中加入NaOH溶液则得棕黑色沉淀D和绿色溶液E。向A中通入过量SO2则溶液最后变为粉红色溶液F,向F加入过量氨水得白色沉淀G和棕黄色溶液H。G在空气中缓慢转变为棕黑色沉淀。将D与G混合后加入硫酸又得溶液A。给出A~H所代表的主要化合物或离子。
正确答案:A.MnO4-+Co2+
B.[CoCl4]2-
C.Cl2
D.Co(OH)3
E.MnO42-
F.Mn2++Co2+
G.Mn(OH)2
H.[Co(NH3)6]2+ -
第8题:
20℃时,两份等质量饱和的氢氧化钠溶液,一份加入少量氢氧化钠固体,恢复到常温,得到溶液Ⅰ;另一份冷却到5℃,得到溶液Ⅱ。溶液Ⅰ和溶液Ⅱ相比,下列说法正确的是()
- A、溶液Ⅰ中氢氧化钠的质量分数大
- B、两溶液的pH相等
- C、无法比较两溶液中氢氧化钠质量分数的大小
- D、溶液Ⅰ的pH小
正确答案:A -
第9题:
将黄色晶体A溶于水后通入SO2得绿色溶液B。向B中加入过量NaOH溶液得绿色溶液C。向C中加H2O2得黄色溶液D。将D酸化至弱酸后加入Pb(NO3)2有黄色沉淀E生成。试确定A,B,C,D,E各是什么物质?
正确答案:A.K2CrO4
B.Cr3+
C.Cr(OH)4-
D.CrO42-
E.PbCrO4 -
第10题:
填空题重铬酸钾(K2Cr2O2)溶液中存在如下平衡:往此溶液中加入过量氢氧化钠,平衡____移动,溶液呈____色.正确答案: 向右(或向正反应方向),黄解析:
提示:加过量NaOH中和H+,使平衡向右移动,使橙红色的Cr2O72-转变成黄色的Cr2O42-. -
第11题:
单选题下列离子的检验方法合理的是()。A向某溶液中滴加KSCN溶液呈红色,说明不含Fe2+
B向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
正确答案: C解析: 暂无解析 -
第12题:
单选题20℃时,两份等质量饱和的氢氧化钠溶液,一份加入少量氢氧化钠固体,恢复到常温,得到溶液Ⅰ;另一份冷却到5℃,得到溶液Ⅱ。溶液Ⅰ和溶液Ⅱ相比,下列说法正确的是()A溶液Ⅰ中氢氧化钠的质量分数大
B两溶液的pH相等
C无法比较两溶液中氢氧化钠质量分数的大小
D溶液Ⅰ的pH小
正确答案: A解析: NaOH的溶解度随温度升高而增大,溶液Ⅰ仍然是20℃时的饱和溶液,溶液Ⅱ是5℃时的饱和溶液,溶液Ⅰ中NaOH的质量分数比溶液Ⅱ中的大,溶液Ⅰ的pH比溶液Ⅱ的pH大。 -
第13题:
在酸性溶液中,消除由O2而产生的氧波的方法是()。
- A、在溶液中通入N2.H2等气体
- B、在溶液中通入CO2气体
- C、在溶液中加入NA2S03晶体数粒
- D、在溶液中加入抗坏血酸
正确答案:A,B,D -
第14题:
某一金属盐溶液,加入适量Na2CO3生成灰绿色沉淀,再加入H2O2并煮沸,此时溶液呈黄色,冷却并酸化此溶液,再加入H2O2溶液呈蓝色,此蓝色化合物在水中不稳定,在乙醚中较稳定,写出上述各反应的离子方程式
正确答案:加Na2CO3:CO32-+H2O===HCO3-+OH-
Cr3++3OH-=Cr(OH)3↓(灰绿色)
加H2O2煮沸:
2Cr(OH)3+3H2O2+4OH-===2CrO42-(黄色)+8H2O
酸化:
2CrO42-+2H+Cr2O72-+H2O
再加H2O2:
Cr2O72-+4H2O2+2H+====2CrO5(深绿色)+5H2O -
第15题:
为把TiCl4变为TiCl3,下列方法中错误的是()
- A、在灼热管中通入干燥的TiCl4和H2的混合气体
- B、向TiCl4溶液中加入锌粒
- C、用镁还原气态的TiCl4
- D、向TiCl4溶液中加入镁粉
正确答案:C -
第16题:
常温下,向Pb(NO3)2溶液中加入NaCl溶液得白色沉淀A,将A分离后溶于盐酸,再通入H2S气体得黑色沉淀B.将B分离后,加入H2O2溶液得白色沉淀C,A、B、C各为何物,写出有关反应式
正确答案:A.PbCl2,B:PbS,C://PbSO4
有关反应为:Pb2++2Cl-=PbCl2↓(白)
PbCl2+HCl=HPbCl3
PbCl3-+H2S=PbS↓(黑)+2H++3Cl-
PbS+4H2O2=PbSO4↓(白)+4H2O -
第17题:
用氢氧化钠标准溶液测定H2O2中游离酸时,以()为指示剂,溶液终点颜色由()变为()。
正确答案:甲基红——次甲基蓝;红紫色;亮绿色 -
第18题:
A的水合物为紫色晶体。向A的水溶液中加入Na2CO3溶液有灰兰色沉淀B生成。B溶于过量NaOH溶液得到绿色溶液C。向C中滴加H2O2得黄色溶液D。取少量溶液D经醋酸酸化后加入BaCl2,溶液则析出黄色沉淀E。将D用硫酸酸化后通入SO2,得到绿色溶液F。将A的水溶液加入硫酸后加入KI溶液,经鉴定有I2生成,同时放出无色气体G。G在空气中逐渐变成棕色。给出A~G所代表的主要物质。
正确答案:A.Cr(NO3)3
B.Cr(OH)3
C.Cr(OH)4-
D.CrO42-
E.BaCrO4
F.Cr2(SO4)3
G.NO -
第19题:
向1升0.1 mol·L-1的弱酸HA(Kθa=1×10-5)溶液中加入固体NaOH(式量为40)2克后,溶液的PH值()(lg0.05=-1.3)
- A、3.2
- B、11.8
- C、9.0
- D、5.0
正确答案:A -
第20题:
将浅绿色晶体A溶于水后加入氢氧化钠和H2O2并微热,得到棕色沉淀B和溶液C。B和C分离后将溶液C加热有碱性气体D放出。B溶于盐酸得黄色溶液E。向E中加KSCN溶液有红色的F生成。向F中滴加SnCl2溶液则红色褪去,F转化为G。向G中滴加赤血盐溶液有蓝色沉淀生成。向A的水溶液中滴加BaCl2溶液有不溶于硝酸的白色沉淀H生成。给出A~H所代表的主要化合物或离子。
正确答案:A.(NH4)2SO4·FeSO4·6H2O
B.Fe(OH)3
C.NH3·H2O
D.NH3
E.FeCl3
F.[Fe(NCS)n]3-n
G.FeCl2
H.BaSO4 -
第21题:
向一升0.1mol/LHA(pKA=5.0)溶液中加入2克固体氢氧化钠(M=40g/mol)后,溶液的pH值与哪一个最为接近()
- A、3.0B、3.7
- B、5.0
- C、0.006mol/L
- D、6.3
正确答案:C -
第22题:
问答题在1L水中,加入500ml20%的H2SO4溶液,已知密度为1.14g/cm3,求该硫酸溶液的摩尔浓度(1/2H2SO4)是多少?正确答案: 溶质H2SO4的质量为:500×20%×1.14=114g
稀硫酸溶液的总体积为:1000+500=1500ml
C1/2H2SO4=114÷1500÷49×1000=1.55mol/L
故该溶液的摩尔浓度为1.55mol/L。解析: 暂无解析 -
第23题:
单选题除去FeCl3溶液中混有的FeCl2,可向溶液中( ).A加入Cu
B加入Fe
C通入适量Cl2
D通入过量H2S
正确答案: C解析:
加入Cu、Fe和H2S均会使Fe3+被还原成Fe2+.
